若手研究者の育成
注目の歯科基礎医学研究者!第二弾!
長崎大学大学院医歯薬学総合研究科医療科学専攻フロンティア口腔科学分野
准教授 佐藤啓子
P. gingivalis の産生するジンジパインは歯周組織を傷害し、免疫系因子を分解することからP. gingivalis の主要病原因子として知られている。このジンジパインを分泌する装置として9型分泌装置(T9SS)が見つかった。シトルリン化酵素、赤血球凝集因子など、ジンジパインを含めた30種類以上の病原因子がT9SSから分泌される。さらに、T9SSは歯周病関連菌の Tannerella forsythia, Prevotella intermedia 等、Bacteroidota門細菌に広く保存されており、病原性発現に寄与する。
一方、T9SSはタンパク質分泌装置としてだけでなく、滑走運動装置としても機能する。滑走運動は固形表層上を滑るように動く運動で、土壌細菌 Flavobacterium johnsoniae はT9SS滑走運動でバイオフィルムを拡張する。水産分野では、サケ・マス・アユ冷水病の病原菌 Flavobacterium psychrophilum、コイ科魚類のカラムナリス病の病原菌 Flavobacterium columnare のT9SSもタンパク質分泌と運動性の両方の機能をもち、T9SS欠損株では病原性が著しく低下することが報告された。アユ冷水病は、体側や尾部の潰瘍症状(穴あき)、下顎やエラの欠損・出血を主な病状とし、時に大量死を起こす。

「病原性が、、」と書かれることが多いが、自分自身は、寒天培地上でのコロニーの色や形態に惹かれて観察してきた。P. gingivalis では、血液寒天培地上のコロニーの黒・白・グレーの色(ジンジパインが菌体表層にアンカーされれば黒、されなければ白、菌体表層に半端なジンジパイン活性だとグレー)、Flavobacterium 属ではコロニーの広がり方(滑走すると同心円状に広がり、滑走しなければスポットしたままの大きさ)が気になり、「どうしてそうなるのか」を見てきた。そして、これらの分かりやすい表現型は病原性につながっていた。分泌装置の結晶構造解析をさせていただき(大阪大学理学部、蛋白質研究所との共同研究)、バイオフィルムや菌体の微細構造を電子顕微鏡やASEMで解析させていただき(産業技術総合研究所との共同研究)、魚病と歯周病の共通点探索のためにアユ冷水病菌や120匹の鮎をいただき(岐阜水産研究所との共同研究)、数々の貴重な機会に感謝している。進展がみられないことや、実験方法が分からないことも多い。最近はマウスも観察することが多くなった。細菌と違い、多細胞集合体としての個体を扱うのがとても興味深い。
長崎大学大学院医歯薬学総合研究科医療科学専攻
生命医科学講座歯科薬理学分野
助教 山口優
皆様、お初にお目にかかります。長崎大学大学院医歯薬学総合研究科医療科学専攻生命医科学講座歯科薬理学分野の山口優と申します。このたびの企画に参加できることを大変光栄に思います。
現在、研究しているテーマの一つはRab44という新規遺伝子に関するものです。Rab44はRabファミリーに属するGTPaseの一つであり、Rabファミリーは細胞内の小胞輸送や細胞の極性形成、シグナル伝達などに重要な役割を果たすことが知られています。これまでの研究で、Rab44が特に破骨細胞の分化において重要な役割を担っていることを明らかにしています。具体的には、Rab44はNFATc1 経路を介して破骨細胞分化を負に制御していることを見出しました。
さらに、Rab44の機能解析の一環として、その相互作用タンパク質も研究しています。特に注目されるのは、Rab44がアクチン結合タンパク質であるCoronin1Cと相互作用することです。この相互作用は、Rab44の不活性型であるGTP型でのみ認められ、破骨細胞の分化に影響を与えることが示されています。
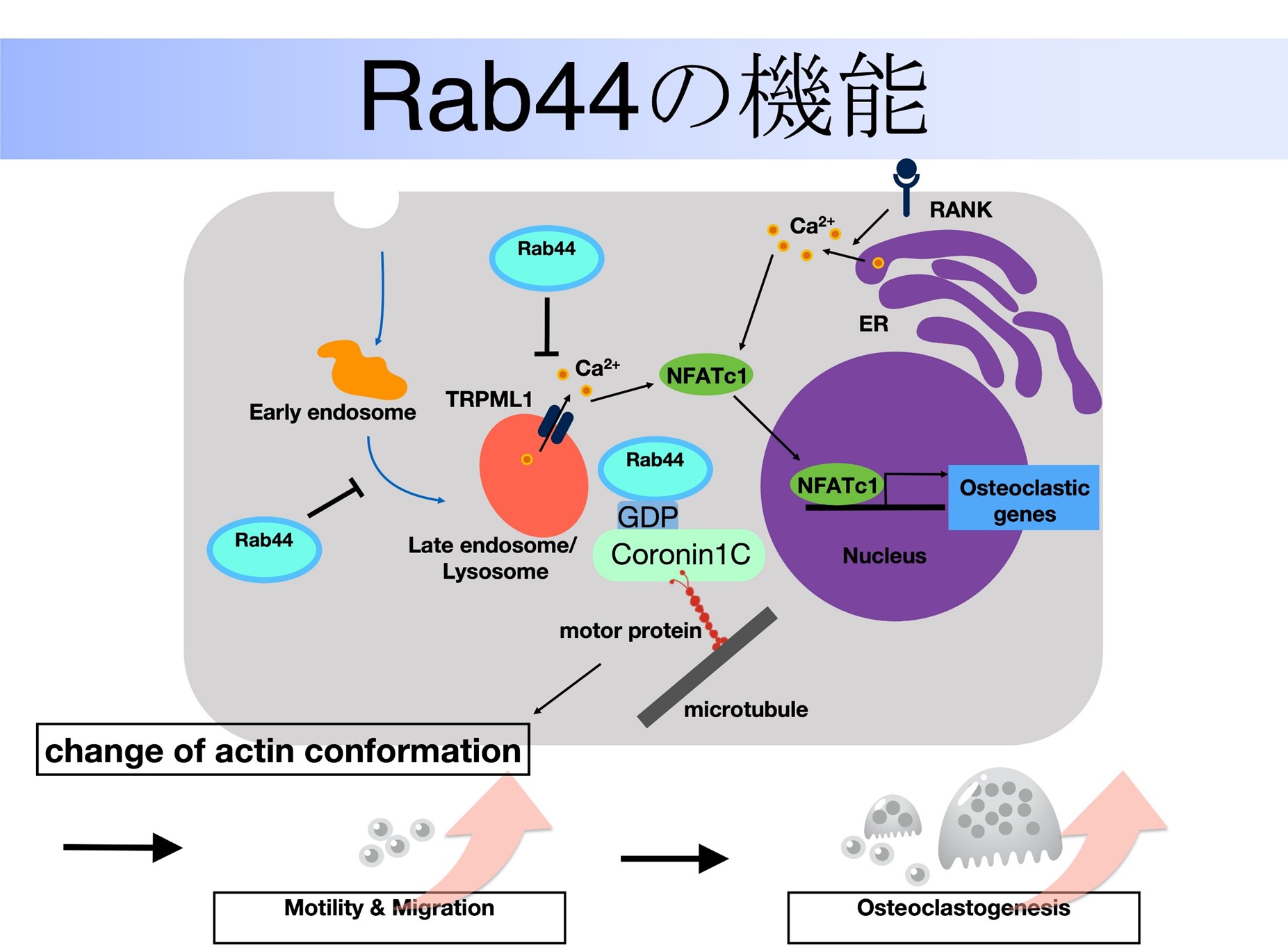
破骨細胞は、骨の分解を担う細胞であり、関節リウマチにおいては炎症性破骨細胞前駆細胞の機能亢進がみられます。一般的に破骨細胞の過剰な活性化が関節リウマチの病態形成に関与していることが示唆されています。そこで、Rab44遺伝子の関節リウマチにおける破骨細胞の活性化への影響も研究しています。具体的には、Rab44遺伝子ノックアウトマウスを用いて、関節リウマチにおける破骨細胞の活性化や関節破壊の進行を観察しています。この研究は、関節リウマチの治療法の開発に向けた新たなアプローチを提供するものだと思っております。
さらに、当分野では学部学生や大学院生の指導にも重点を置いています。私も学部生時代から研究に取り組んできましたが、その経験から、問題解決能力を養うことや、大学院での研究に進むきっかけを提供することが、学生たちにとって非常に有益だと感じています。次世代の歯科基礎医学研究者を育てることは、私の重要な使命の一部だと考えています。
今後も、歯科基礎医学の分野での研究に情熱を注ぎ、新たな知見を得るために努力していきます。皆様との交流や情報交換を通じて、より良い研究成果を目指せればと思っております。
最後に、このような貴重な機会を与えていただき、心から感謝申し上げます。引き続きご支援とご鞭撻を賜りますよう、何卒よろしくお願い申し上げます。
北海道大学大学院歯学研究院 口腔機能学分野冠橋義歯補綴学教室
教授 黒嶋伸一郎
皆さん初めまして,黒嶋伸一郎と申します.私は補綴歯科学と口腔インプラント学を専門として日々患者さんの歯科治療を行っております.一方で,基礎的な研究にも力を入れており,2010年から一貫して薬剤関連顎骨壊死(Medication-related osteonecrosis of the jaw;MRONJ)に関する基礎的・臨床的研究を,また,2013年からはこちらも一貫して骨質制御機構の解明と骨質を基盤としたデンタルインプラント開発に関する研究をそれぞれ行っています.
MRONJは2003年に初めて臨床報告がなされましたが,現在でも病態形成機構が不明で,確定的な治療法や予防法がない難治性の硬軟組織難治性疾患であり,多くのMRONJ患者さんが口腔関連QoLやQoLの低下に困っていることから,留学先のミシガン大学(2010~2012年)でMRONJ研究をスタートさせました.当時は,有用なMRONJモデル動物がほとんどいなかったことから,臨床的状況を模倣したMRONJモデルマウス/ラットを作製してMRONJの病態や治療法に関する様々な基礎的研究を行っていました.長崎大学に着任後もMRONJの研究を継続し,現在までに合計8種類のMRONJモデル動物や7種類のMRONJレスキュー・悪化モデル動物を開発しながら臨床研究も展開しており,現在では遺伝子改変マウスと1細胞解析を用いてMRONJの病態形成機構に関連する細胞の同定に挑戦しています.
一方,インプラントの研究については,2000年に米国国立衛生研究所が提唱した新しい概念の骨質に基づいて,荷重環境下におけるインプラント周囲の骨質制御機構解明のための基礎的研究を行い,骨質制御に必要な候補分子の探索を行っています.また,一連の基礎的研究と非臨床試験から歯工産学連携(長崎大学,大阪大学,京セラ株式会社)により,大学発のデンタルインプラントを開発して2017年に上市となり,2023年には表面性状の基礎的研究を基盤としてさらなる新規インプラントが上市されました.
このように2つの研究を基軸として基礎的・臨床的研究を行ってまいりましたが,これからも患者さんの歯科治療に貢献するための基礎的研究を積極的に行っていきたいと考えています.最後に,今まで研究のご指導を頂いてきました吉田重光先生(元北海道大学),沢 禎彦先生(現岡山大学),山下潤朗先生(元ミシガン大学),Laurie K McCauley先生(現ミシガン大学),中野貴由先生(現大阪大学),石本卓也先生(現富山大学),澤瀬 隆先生(現長崎大学)ほか,多くの先生方に深く感謝申し上げます.

昭和大学 歯学部 口腔病態診断科学講座 口腔病理学部門
准教授 田中準一
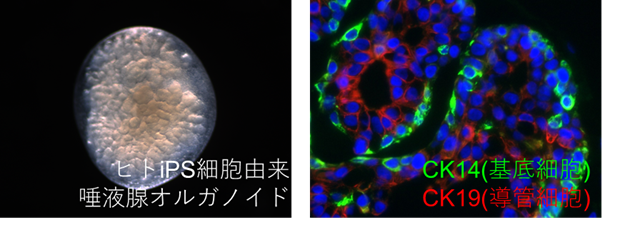
我々の研究グループは、これまでマウスES細胞から3次元的な唾液腺組織(唾液腺オルガノイド)を誘導し、その手法を改変することで、ヒトiPS細胞からも唾液腺オルガノイドを誘導することに成功しました(図)(Tanaka J, et al, Nat Commun, 2018. Tanaka J, et al, Nat Cell Biol, 2022)。これまで、ES・iPS細胞から唾液腺を誘導した報告はなく、我々のグループが世界に先駆けて報告することができ、マウス唾液腺オルガノイドはScience誌の「In other journals」に取り上げられ、ヒト唾液腺オルガノイドはNature Cell Biology誌の表紙に採用されるなど、国際的にも高い評価を受けました。さらに、この唾液腺オルガノイドは唾液腺を切除した免疫不全マウスへの移植で口腔内への唾液分泌経路を保ちながら生着させることが可能でした。これは将来的な唾液腺オルガノイド移植による唾液腺再生医療の可能性を示すものでした。
最近では、慶応義塾大学のグループがiPS細胞から作製した心筋オルガノイドをヒトに移植し治療効果が得られたとの報告がなされるなど、医科分野では急速に再生医療開発が進んでいます。そのような背景で、歯科医学会が掲げた歯科イノベーションロードマップでも「幹細胞とiPS細胞を使って唾液腺の再生が可能に。」が第3期に掲載され、歯科医療における再生医療開発は急務であるといえます。特に、健康寿命の延伸に向けた唾液腺再生医療開発は、再生医療先進国の日本でこそ実現可能な次世代再生医療になりえるのでは無いかと考えています。
わたしは大学院から昭和大学口腔病理学部門に所属し、美島健二教授のもと唾液腺発生再生研究を行ってきました。研究開始当初は唾液腺誘導が全くうまくいかず、ネガティブデータを出し続けていましたが、ネガティブデータでも少しずつ誘導方向を理解していることが面白くて研究を継続していました。初めてES細胞から唾液腺が発生してきたときの興奮は筆舌に尽くしがたく、勇み足でデータを見せに向かったことを記憶しています。
唾液腺オルガノイドの臨床応用に向けては、移植方法の開発や誘導効率の改善など多くの課題を残していますが、基礎研究を臨床シーズとして昇華させるべく日々研究活動を行っています。末筆になりましたが、唾液腺オルガノイド開発に向けての研究指導と、辛抱強く研究を継続させていただいた美島教授、そして共同研究者として多くのご指導を頂いた学内外の先生方にこの場を借りて感謝申し上げます。
